ilk önce kimya mol kavramı çözen uygulamanın tanımını verip bunu da uygulama şeklinde örnek olarak inceleyelim. İlk bölümde size mol kavramını ve ifadelerini açıkladıktan sonra ikinci bölümde bu açıklamaları uygulamaya dönüştürerek örnek bir kodla programa dönüştürelim.
Kimya Mol Kavramı Çözen Uygulama
Kimya’da mol kavramını c++ kodlmasını kullanarak programa dönüştürdüm. Açık Kaynak için ziyaret ediniz:
Bu linkten hesaplayabilirsiniz
Github üzerindeki açık kaynak kodları
#include <iostream>
using namespace std;int main()
{
char a;
char b;
int asayi;
int bsayi;
int akutle;
int bkutle;
float mol;
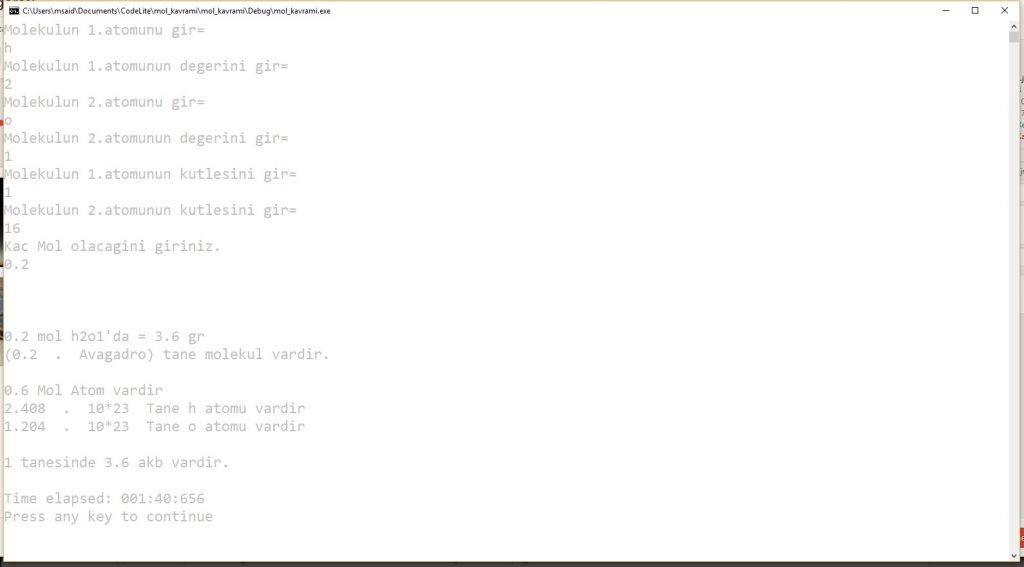
cout<<“Molekulun 1.atomunu gir= “<<endl;
cin>>a;
cout<<“Molekulun 1.atomunun degerini gir= “<<endl;
cin>>asayi;
cout<<“Molekulun 2.atomunu gir= “<<endl;
cin>>b;
cout<<“Molekulun 2.atomunun degerini gir= “<<endl;
cin>>bsayi;
cout<<“Molekulun 1.atomunun kutlesini gir= “<<endl;
cin>>akutle;
cout<<“Molekulun 2.atomunun kutlesini gir= “<<endl;
cin>>bkutle;
cout<<“Kac Mol olacagini giriniz. “<<endl;
cin>>mol;
cout<<endl<<endl<<endl;
cout<<mol<<” mol “<<(char)a<<asayi<<(char)b<<bsayi<<“‘da = “<<mol*((asayi*akutle)+(bsayi*bkutle))<<” gr “<<endl;
cout<<“(“<<mol<<” . Avagadro)”<<” tane molekul vardir.”<<endl;
cout<<endl;
cout<<float((asayi+bsayi)*mol)<<” Mol Atom vardir”<<endl;
cout<<float(asayi*mol)*6.02<<” . 10*23 “<<” Tane “<<a<<” atomu vardir “<<endl;
cout<<float(bsayi*mol)*6.02<<” . 10*23 “<<” Tane “<<b<<” atomu vardir “<<endl;
cout<<endl;
cout<<“1 tanesinde “<<mol*((asayi*akutle)+(bsayi*bkutle))<<” akb vardir.”<<endl;
}
( mol kavramı çözen program )
Bağıl Atom Kütlesi
Atomlar gözle görülemeyecek kadar küçük tanecikler olduğu için standart kütle birimleri kullanmak değer açısından çok büyük sonuçlar ortaya çıkaracağından yeni bir kütle birimi geliştirilmiştir.
1961 yılında IUPAC (Uluslararası Uygulamalı ve Teorik Kimya Birliği) 12C atomunun kütlesini yaklaşık 12.000 olarak alıp 1/12’sini 1 tane atomun kütlesi olarak belirtmiştir. Gerçek atom kütlesi olarak kabul edilen bu değere atomik kütle birimi denmiştir.
Diğer elementlerin kütleleri ise 12C esas alınarak karşılaştırılmış ve bulunan değerlere bağıl atom kütlesi denmiştir. Bağıl atom kütlesine atom kütlesi denilebilir.
1 tane 12C atomunun kütlesinin 1/12’sine 1 atomik kütle birimi (akb) denir. Akb mol kavramı için çok önemli bir ölçümdür.
Mol Kavramı Nedir?
Kimya biliminin alfabesi sayılabilecek konu mol kavramı konusudur. Mol kavramının iyi anlaşılması için önce bağıl atom kütlesi incelenmelidir.
Madde, atom ve moleküllerin sayılamayacak küçüklükte miktarlarından oluştuğuna göre, bu taneciklerin miktarını belirlemek için oluşturulan birime ”mol” denir.
1 mol taneciğin (atom, molekül veya iyon) kütlesine mol kütlesi denir. Örneğin H: 1 g/mol, O:16 g/mol…
Herhangi bir elementin miktarı artırıldığında diğer elementlerle olan oranı sabit kalır. Bu durumda her elementin bağıl atom kütlesi kadar miktarında eşit sayıda atom bulunur. Bu miktarı 1 atom – gram miktarı denir. 1 atom – gram elementteki atom sayısı 6,02.1023 tanedir. Bu sayıyı İtalyan bilim adamı Amedeo Avogadro adına atfen Avogadro sayısı denilmiştir.
Mol kavramı avagadro sayısı kadar tanecik için kullanılır.
1 mol tanecik = 6,02.1023 tane tanecik = NA
- 1 mol – molekül = 6,02×1023 tane molekül
- 1 mol – atom = 6,02×1023 tane atom
- 1 mol NH3 molekülü 6,02×1023 tane NH3 molekülü
- 1 mol Ca atomu 6,02×1023 tane Ca atomudur.
Atom – Molekül Kütlesi
Bir elementin 1 mol (6,02.1023 tane) atomunun gram olarak kütlesine atom kütlesi denir. Örneğin 1mol Ca 40 gramdır.
1 mol molekülün gram olarak kütlesine o bileşiğin molekül kütlesi denir. Bir bileşikteki elementlerin bağıl atom kütlelerinden yararlanılarak molekül kütlesi hesaplanır. Örneğin N: 14 ve O 16 olmak üzere N2O5 bileşiğinin molekül kütlesi:
N2O5 → 2N + 5O = 2.14 + 5.16 = 108 g N2O5 bileşiğinin molekül kütlesi 108g/mol dür.
1 mol tanecik kütlesi: Atom ya da molekül kütlesi (MA) gramdır.
- Elementlerde, Atom – gram
- Moleküllerde, Molekül – gram
- İyonlarda, İyon – gram
- Bileşiklerde, formül – gram
Bütün bu kavramlar yerine mol kavramı aynen kullanılabilir.
- 3 mol Mg atomu = 3 atom – gram Mg
- 1 mol CH4 molekülü = 2 molekül – gram CH4
- 1 mol S04-2 iyonu = 2 iyon – gram S04-2
- 1 mol BeF2 bileşiği = 2 formül – gram BeF2
- 2 mol O2 molekülü = 3 molekül – gram O2
Atomik Kütle Birimi (akb)
1 tane 12C kütlesinin 1/12’sine 1 akb denir.
1 tane taneciğin kütlesi MA.akb’dir.
1 tane taneciğin gram cinsinden kütlesi MA/NA ile bulunur.
(MA: Molekül kütlesi, NA: Avogadro sayısı)
Buna göre, 40Ca atomu için aşağıdaki yargılara ulaşılabilir.
6,02.1023 tane Ca atomu 40 gramdır.
1 tane Ca atomu 40 akb dir.
1 atom – g Ca 40 gramdır.
1 tane Ca atomu 40/avagadro sayısı gramdır. Bu değere Ca nın gerçek atom kütlesi denir.